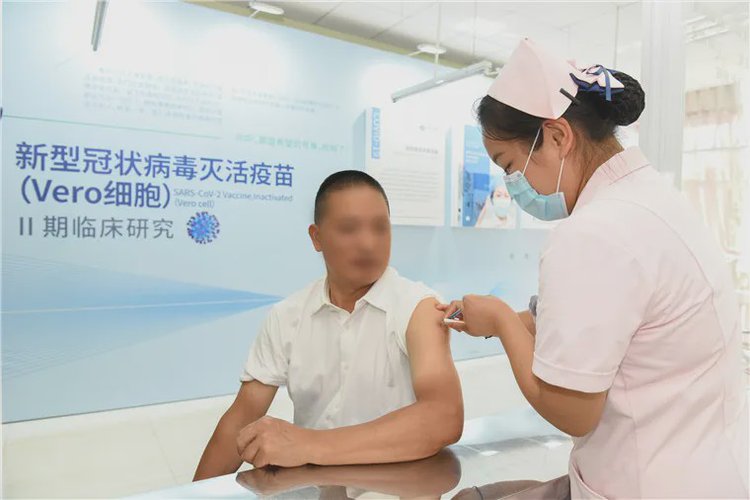
新型冠状病毒灭活疫苗6月20日在云南省红河州进入Ⅱ期临床试验 中国生物技术网 图
由中国医学科学院医学生物学研究所(以下简称医科院生物所)自主研制的新型冠状病毒灭活疫苗,6月20日下午在云南省红河州进入Ⅱ期临床试验。
“在目前全球疫情依然严峻复杂的形势下,我们数月的努力,为全球抗疫再次打了一剂强心针。”医科院生物所负责人向科技日报记者表示。
新冠肺炎疫情发生以来,曾成功研制我国首个Sabin株脊髓灰质炎灭活疫苗、肠道病毒EV71型灭活疫苗的医科院生物所,根据党中央、国务院的总体部署,在中国医学科学院的领导下,义不容辞地承担疫情防控科研攻关任务,成立应急疫苗研发攻关组,在应急疫苗研发、动物模型建立、病毒溯源及传播机理研究等方面开展科研攻关。通过综合多学科力量加快科研攻关,在坚持科学性、确保安全性的基础上加快了疫苗研发进度。
今年2月初,医科院生物所即已启动病毒分离选育工作,并在细胞上进行适应传代培养,完成了疫苗生产毒种的筛选和鉴定,建立了三级种子库并通过了中国食品药品检定研究院的检定。利用“国家昆明高等级生物安全灵长类动物研究中心”的资源优势,初步建立了用于疫苗安全性和保护效果评价的恒河猴动物模型。
3月,旋即开展了SARS-CoV-2感染致病机制及免疫学研究,为疫苗研发奠定了扎实基础,确定了疫苗关键生产工艺体系以及质量控制的标准体系;完成了疫苗在非人灵长类动物体内的安全性、免疫原性及保护效果的评价。
科技日报记者了解到,5月13日,医科院生物所收到了国家药品监督管理局下发的《药物临床试验批件》,批准开展Ⅰ/Ⅱ期临床试验。5月15日,正式在四川大学华西第二医院启动Ⅰ期临床研究,采用随机、双盲、安慰剂对照的设计,根据试验方案逐步推进。截至目前,已完成近200例18至59岁健康成年人的入组,顺利完成Ⅰ期临床试验。
6月20日正式启动的Ⅱ期首批人群临床研究,将对疫苗在健康人群中接种的免疫原性和安全性开展进一步评价,并确定免疫程序和免疫剂量。Ⅱ期临床研究由云南省疾病预防控制中心疫苗临床研究中心负责组织实施,在云南省弥勒市疾病预防控制中心和云南省个旧市疾病预防控制中心两个研究现场同步启动筛选入组工作。
在新冠肺炎疫情全球大流行的背景下,疫苗成为最能有效解决危机的希望。“作为国家公益性事业单位,医科院生物所践行‘国家队’的使命担当,秉承严谨科学的态度,依托国家生物安全重大科技基础设施支撑,充分利用针对人类重大传染病重要技术储备力量,稳健推进新型冠状病毒灭活疫苗的临床研究。”这位负责人表示,他们将尽全力,争取早日为人民群众提供安全、有效和质量可控的疫苗,为保障人民生命健康、维护国家公共卫生安全和全球共同应对新冠肺炎疫情作出新的贡献。
此前,医科院生物所新型冠状病毒灭活疫苗的研究已取得阶段性成果,在积极开展临床试验的同时,产业化实施的工作也在稳步推进,该所在昆明疫苗产业基地规划并设计具有生物安全防护的GMP生产车间,用于新冠灭活疫苗的产业化实施,预计在2020年下半年投入使用,确保国家应急疫苗的供应任务。
医科院生物所长期以来从事病毒疫苗的研发、生产工作。1957年,老一辈科学家顾方舟临危受命,带领研究团队开始进行脊髓灰质炎研究工作。医科院生物所先后研制、生产了脊髓灰质炎减毒活疫苗和Sabin株脊髓灰质炎灭活疫苗,供应全国使用,让数十万儿童免于致残。
另据科技部、国家卫健委6月19日通报,我国科研攻关团队按照灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗和核酸疫苗等5条技术路线,共布局了12项疫苗研发任务。目前,已对1个腺病毒载体疫苗和4个灭活疫苗开展了临床试验,占全世界开展临床试验疫苗总数的4成。
来源/科技日报
编辑/樊宏伟