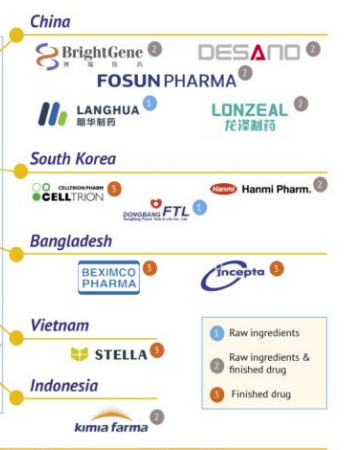
据日内瓦药品专利池(MPP)网站20日消息,该组织已与27家仿制药公司签署协议,授权其生产默沙东口服新冠药莫努匹韦(molnupiravir)。其中包括5家中国企业:复星医药、朗华制药、龙泽制药、博瑞医药、迪赛诺医药。
根据MPP此前与默沙东的协议,包括中国企业在内的27家仿制药公司无需支付专利费用。
药品专利池网截图
综合公开资料,莫努匹韦由默沙东和Ridgeback联合开发,它是全球首款获批的口服抗新冠病毒药物。莫努匹韦3期临床试验的研究结果显示,早期治疗服用莫努匹韦,可显著降低未接种疫苗的新冠肺炎高危成年患者的住院或死亡风险。
2021年11月,莫努匹韦获得英国药品和健康产品管理局(MHRA)附条件批准上市。随后获得美国食品药品监督管理局(FDA)紧急使用授权,以及日本厚生劳动省紧急特例批准。
综合Harvard T.H. Chan公共卫生学院2021年10月的信息等公开资料,莫努匹韦1个疗程的药物,其生产成本约为17美元左右,正常售价可高达700美元,药价是成本价的40多倍。
在获批前,默沙东与联合国支持下的公共卫生组织MPP签署了莫努匹韦的许可协议。MMP通过默沙东授予的许可,可向制造商授予“MPP分许可”,用以增加莫努匹韦的生产基地,提高药物的供应数量和覆盖范围,供应105个中低收入国家(LMIC)。
2021年进博会上的默沙东展台 图源澎湃新闻
据路透社20日消息,参与谈判的MPP官员对其透露,预计在较贫穷国家,莫努匹韦为期5天共40粒(每日服用两次,每次4 粒)的单疗程花费约20美元。不过,想要交付莫努匹韦,还需获得各国监管部门的进一步批准。
莫努匹韦的效果依然受到质疑。路透社提到,虽然莫努匹韦在印度获得紧急授权,可以上市销售。“但由于存在安全风险,目前不建议使用。”
路透社报道截图
MMP本月20日新闻稿表示,根据协议,只要新冠肺炎仍被世界卫生组织列为国际关注的公共卫生突发事件,默沙东及其合作伙伴Ridgeback Biotherapeutics,以及发明该药物的美国埃默里大学都不会从“MPP分许可”持有人的莫努匹韦销售中收取特许权使用费。
MMP称,经机构独立评审,本次获得许可的企业证明了他们有能力满足药品专利池组织对产能和监管合规的要求,能够生产符合国际质量标准的药品。全球共有13家获许可同时生产莫努匹韦原料药和成品药,另有5家药企获授权生产原料药,9家药企获授权生产成品药。
其中,来自中国的复星医药、博瑞医药、(石家庄)龙泽制药与(上海)迪赛诺获许可同时生产莫努匹韦的原料药和成品药,维亚生物旗下的朗华制药则获许生产莫努匹韦的原料药。
药品专利池网站截图
莫努匹韦不是世界上唯一的口服新冠药物。
由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心等共同研发的VV116,与获批上市的默沙东莫努匹韦和辉瑞帕昔洛韦同属新冠治疗小分子药物。
VV116已经在国内获批进入临床试验。此外,当地时间2021年12月30日,VV116在乌兹别克斯坦获得紧急使用授权。据澎湃新闻消息,在年内通过临床试验后,VV116将第一时间启动上市(NDA)申请。
来源/观察者网
编辑/樊宏伟